Алюминий (Al)
Алюминий относится к наиболее распространенным цветным металлам. Открытый в 1825 году и до освоения технологии промышленного изготовления стоивший дороже золота, элемент с атомным номером 13 и массой в 26,982 а. е. м. имеет плотность 2,7 г/см^3 и отличается наличием парамагнитных свойств, правда, слабых.
Хорошо проводит тепло и электричество, не поддается коррозионному воздействию, зато подвержен механическому, в том числе легко подвергается сгибанию. Сплавы на основе этого легкого металла характеризуются пластичностью, удовлетворительной прочностью и не поддаются коррозии, а также хорошо свариваются.
Алюминий, фото: https://ru.wikipedia.org/
По распространенности в мире алюминий стоит на первом месте среди металлов и на третьем среди химэлементов периодической таблицы, уступая только кислороду и кремнию. Добыча его ведется более чем в 15 странах, лидеры среди которых — Китай, Россия и Канада. Мировые запасы этого элемента в разы превышают текущую потребность в его применении.
Сфера использования алюминия и сплавов на основе этого материала обширна. Это и черная металлургия, и пиротехника, использовался даже для изготовления ювелирных украшений в тот период, когда представлял исключительную ценность из-за неотработанного техпроцесса. В Японии он применяется в таком качестве до сих пор, заменяя иногда серебро в украшениях.
О посуде и столовых приборах из этого гибкого металла знают все, а вот в качестве конструкционных материалов используют преимущественно алюминиевые сплавы, обладающие требуемыми характеристиками в плане прочности. Также алюминий добавляют в «автоматные стали» для облегчения обработки — благодаря ему достигается четкое открепление от прута детали после завершения обработки.
Как и где добываются редкие металлы?
Все страны мира пытаются добывать как можно больше металлов. Особенно хорошо дела складываются у Китая — в некоторых источниках говорится, что он производит до 50% металлов, необходимых для высокотехнологической промышленности. Другие государства тоже занимаются добычей материалов, но зачастую их не хватает. Больше всего проблем возникает с редкими металлами вроде кобальта, галлия, индия и так далее. Дело в том, что они не встречаются в природе в чистом виде, и их необходимо извлекать из медных, алюминиевых и других руд. Содержание попутных металлов в рудах может значительно отличаться, поэтому уверенности в том, что добытчикам удастся найти достаточное количество ценных материалов, нет.

Редкие металлы, в том числе и кобальт, не встречаются в чистом виде
Считается, что все необходимые для комфортной жизни людей металлы имеются в недрах Земли. На данный момент все добытые металлы были извлечены из месторождений, которые находятся на поверхности. Однако, существует огромное количество «слепых» источников, которые находятся на большой глубине. Ученые организуют экспедиции и иногда их находят, но эта сфера еще плохо развита. Чтобы технологии расцветали и дальше, необходимы эффективные технологии для обнаружения глубоких месторождений.

Миру нужны технологии для исследования недр Земли
В итоге получается, что редкие металлы нужны везде, где можно использовать термин «высокие технологии». В большинстве своем, речь идет о компьютерах — не стоит забывать, что они используются не только для развлечений, но и установлены в автомобили, самолеты и прочую технику. Добыча редких металлов является крайне сложной задачей, поэтому нужно надеяться, что добытчики найдут как можно больше месторождений и они не будут стоить слишком дорого.
Особенности гальванопластики в домашних условиях
Гальванопластика — это процесс нанесения меди на проводящую или непроводящую поверхность изделия с последующим снятием покрытия с негативной матрицы. Таким образом можно получить множество очень точных копий с одного изделия. При этом, есть условие: наращивание меди толщиной не менее 200 мкм, чтобы изделие получилось прочным.
Важно учесть, что, если поверхность изделия не имеет свойств проводника, то потребуется больше усилий – а именно, особое предварительное покрытие графитом, серебром или медью. Основным металлом для осуществления гальванопластики считается медь, но можно выращивать матрицы из серебра чистотой 9999
Обучение гальванике
Можно сделать вывод, что меднение сегодня — это один из наиболее актуальных гальванотехнических процессов, обучиться которому может каждый. Компания «6 микрон» проводит обучение по направлению «Гальваника» для всех желающих! Вы сможете выбрать удобную для Вас программу обучения, которая лучше всего подойдет для гальваники в домашних условиях и не только. Все интересующие вопросы можно задать по телефону или по электронной почте, наши технологи проконсультируют по курсам для обучения.
Видео руководство по меднению деталей в домашних условиях:
Автор материаловДолжность: главный технолог ООО «6 микрон»Образование: высшееОпыт работы в гальванике: 13 лет
При оформлении заказа онлайн скидка 10 %!
Наш приоритет — индивидуальный подход к каждому заказу и качество выполняемых работ!
Новые дополнения в игре для ПК Far Cry 4
В игре много новых введений. Однако, не все новинки являются интересными, или даже полезными. Перечень новинок:
- перенос трупов – теперь игрок может переносить труп, закинув тело на плечо;
- есть возможность взбираться по скалам;
- охотники против главного героя – они могут натравить на игрока животных;
- в игре есть удобный транспорт – тук-тук, гирокоптер и ховеркрафт;
- игрок может выбирать развитие сюжета – есть поворотные моменты;
- доступно несколько концовок;
- главный герой может спать;
- игроку предлагается собирать дневники отца, уничтожать агитплакаты и т.д.;
- в игре очень много дополнительных заданий;
- есть липкие взрывчатки, улучшено оружие, добавлено много новых моделей;
- игрок может собирать солдатские жетоны, потом призывать наёмников по ним.
В целом, в игре Фар Край 4 больше нововведений. Например, когда главный герой убивает животных, то их трупы отмечаются крестиком на карте. Интересно, что теперь игрок может использовать удар ногой. В шутере постоянно транслируется сообщение антагониста. Такие сообщения игрок может слышать во время езды на транспорте. Но после захвата радиовышек сообщения меняются.
Магний (Mg)
Расположенный в таблице Менделеева под 12-м номером ковкий металл с атомной массой 24,307 а. е. м. и плотностью 1,7 г/см^3 впервые был получен в чистом виде в 1808 году. Пластичен и легко поддается прессованию и резанию.
Характеризуется высокой температурой плавления (650 °C) и коррозионной стойкостью. При создании на основе магния сплавов механические характеристики металла существенно повышаются, что сильно расширяет область применения такого рода материалов.
Магний, фото: https://infonew.do.am/
Элемент входит в список наиболее распространенных на Земле и встречается как в коре, так и в морской воде, как правило, в составе солей и минералов. Природные месторождения самородного магния чрезвычайно редки — пара таких расположены на территории России, в Восточной Сибири, и Таджикистана. Лидером по производству магния на 2020-й считаются США.
Главным образом применяется для получения всевозможных сплавов, как легких, так и сверхлегких, сфера использования которых — это самолето- и автомобилестроение. Также благодаря горючим свойствам применяется в пиротехнике и при создании зажигательных и осветительных ракет в оборонной промышленности.
Без магниевого порошка с добавками окислителей прежде невозможной была бы фотография — хотя в сравнении с прошлым магниевые вспышки используются намного реже, спрос на них по-прежнему сохраняется. Также магний относится к веществам, важным для нормальной жизнедеятельности организма и протекания обменных процессов, так что препараты на его основе применяются в медицине — в кардиологии, неврологии и при борьбе с гастроэнтерологическими расстройствами.
Что такое сталь
Сталь представляет собой металлический сплав, состоящий из железа, углерода и нескольких других элементов, таких как марганец, вольфрам, фосфор и сера. Процентное содержание углерода в стали может варьироваться. Сталь можно классифицировать в зависимости от ее химического состава. Существует четыре основных категории:
- Углеродистая сталь
- Легированная сталь
- Нержавеющая сталь
- Инструментальная сталь

Рисунок 2: Сталь используется для строительных целей
В зависимости от количества присутствующего углерода углеродистую сталь можно разделить на несколько групп, таких как:
- Мягкая сталь — углерод до 0,3%
- высокоуглеродистая сталь — содержание углерода 0,3-0,6%
- низкоуглеродистая сталь — более 0,6% углерода
Легированная сталь содержит легирующие элементы, такие как никель, титан, алюминий, хром и т. Д. В различных процентах. Нержавеющая сталь — это особый вид стали, который устойчив к коррозии благодаря присутствию хрома примерно на 10-20%. Инструментальные стали сделаны, чтобы противостоять высоким температурам и условиям давления.
Сталь твердая, очень прочная и пластичная. Но он не устойчив к коррозии (за исключением нержавеющей стали, которая изготавливается путем смешивания хрома с железом, что придает свойства коррозионной стойкости). Сталь легко подвергается коррозии при воздействии влажной среды. Поэтому происходит ржавчина.
Классификация цветных металлов
В зависимости от физических свойств и назначения, они подразделяются на такие группы:
- Легкие цветные металлы. Список этой группы большой: в ее состав входит кальций, стронций, цезий, калий, а также литий. Но в металлургической промышленности чаще всего используются алюминий, титан и магний.
- Тяжелые металлы пользуются большой популярностью. Это всем известные цинк и олово, медь и свинец, а также никель.

- Благородные металлы, такие как платина, рутений, палладий, осмий, родий. Золото и серебро широко применяются для изготовления украшений.
- Редкоземельные металлы — селен и цирконий, германий и лантан, неодим, тербий, самарий и другие.
- Тугоплавкие металлы — ванадий и вольфрам, тантал и молибден, хром и марганец.
- Малые металлы, такие как висмут, кобальт, мышьяк, кадмий, ртуть.
- Сплавы – латунь и бронза.
Химические свойства металлов
Металлы легко отдают электроны, т. е. являются восстановителями. Поэтому они легко реагируют с окислителями.
Вопросы
- Какие атомы являются окислителями?
- Как называются простые вещества, состоящие из атомов, которые способны принимать электроны?
Таким образом, металлы реагируют с неметаллами. В таких реакциях неметаллы, принимая электроны, приобретают обычно НИЗШУЮ степень окисления.
Рассмотрим пример. Пусть алюминий реагирует с серой:
Вопрос. Какой из этих химических элементов способен только отдавать электроны? Сколько электронов?
Алюминий — металл, имеющий на внешнем уровне 3 электрона (III группа!), поэтому он отдаёт 3 электрона:
Поскольку атом алюминия отдает электроны, атом серы принимает их.
Вопрос. Сколько электронов может принять атом серы до завершения внешнего уровня? Почему?
У атома серы на внешнем уровне 6 электронов (VI группа!), следовательно, этот атом принимает 2 электрона:
Таким образом, полученное соединение имеет состав:
В результате получаем уравнение реакции:
Задание 8.5. Составьте, рассуждая аналогично, уравнения реакций:
- кальций + хлор (Cl2);
- магний + азот (N2).
Составляя уравнения реакций, помните, что атом металла отдаёт все внешние электроны, а атом неметалла принимает столько электронов, сколько их не хватает до восьми.
Названия полученных в таких реакциях соединений всегда содержат суффикс ИД:
Корень слова в названии происходит от латинского названия неметалла (см. урок 2.4).
Металлы реагируют с растворами кислот (см. урок 2.2). При составлении уравнений подобных реакций и при определении возможности такой реакции следует пользоваться рядом напряжений (рядом активности) металлов:
![]()
Металлы, стоящие в этом ряду до водорода, способны вытеснять водород из растворов кислот:
Задание 8.6. Составьте уравнения возможных реакций:
- магний + серная кислота;
- никель + соляная кислота;
- ртуть + соляная кислота.
Все эти металлы в полученных соединениях двухвалентны.
Реакция металла с кислотой возможна, если в результате её получается растворимая соль. Например, магний практически не реагирует с фосфорной кислотой, поскольку его поверхность быстро покрывается слоем нерастворимого фосфата:
Металлы, стоящие после водорода, могут реагировать с некоторыми кислотами, но водород в этих реакциях не выделяется:
![]()
Задание 8.7. Какой из металлов — Ва, Mg, Fе, Рb, Сu — может реагировать с раствором серной кислоты? Почему? Составьте уравнения возможных реакций.
Металлы реагируют с водой, если они активнее железа (железо также может реагировать с водой). При этом очень активные металлы (Li – Al) реагируют с водой при нормальных условиях или при небольшом нагревании по схеме:
где х — валентность металла.
Задание 8.8. Составьте уравнения реакций по этой схеме для К, Nа, Са. Какие ещё металлы могут реагировать с водой подобным образом?
Возникает вопрос: почему алюминий практически не реагирует с водой? Действительно, мы кипятим воду в алюминиевой посуде, — и… ничего! Дело, в том, что поверхность алюминия защищена оксидной пленкой (условно — Al2O3). Если её разрушить, то начнётся реакция алюминия с водой, причём довольно активная. Полезно знать, что эту плёнку разрушают ионы хлора Cl–. А поскольку ионы алюминия небезопасны для здоровья, следует выполнять правило: в алюминиевой посуде нельзя хранить сильно солёные продукты!
Вопрос. Можно ли хранить в алюминиевой посуде кислые щи, компот?
Менее активные металлы, которые стоят в ряду напряжений после алюминия, реагируют с водой в сильно измельчённом состоянии и при сильном нагревании (выше 100 °C) по схеме:
Металлы, менее активные, чем железо, с водой не реагируют!
Металлы реагируют с растворами солей. При этом более активные металлы вытесняют менее активный металл из раствора его соли:

Задание 8.9. Какие из следующих реакций возможны и почему:
- серебро + нитрат меди II;
- никель + нитрат свинца II;
- медь + нитрат ртути II;
- цинк + нитрат никеля II.
Составьте уравнения возможных реакций. Для невозможных поясните, почему они невозможны.
Следует отметить (!), что очень активные металлы, которые при нормальных условиях реагируют с водой, не вытесняют другие металлы из растворов их солей, поскольку они реагируют с водой, а не с солью:
А затем полученная щёлочь реагирует с солью:
![]()
Поэтому реакция между сульфатом железа и натрием НЕ сопровождается вытеснением менее активного металла:
![]()
Метки
3D шутер
Action
Adventure
Alawar Entertainment
casual games
CE
Collector’s Edition
Electronic Arts
Elephant Games
Nevosoft
RPG
Stalker
Stalker Shadow of Chernobyl
Игры для iOS
Коллекционное издание
ОП 2.1
Объединенный пак 2.1
Поиск предметов
РПГ
Сталкер
Сталкер прохождение
автосимулятор
аркада
игры для ПК
игры для девочек
игры на Андроид
казуальная игра
казуальные игры
многопользовательская
мультиплатформенная
разное
ресторанный симулятор
симулятор
симы
скачать игру
стратегия
тайм-менеджмент
тактический шутер
три в ряд
триврядка
шутер
шутер от первого лица
шутер от третьего лица
экономическая стратегия
экшен
Самостоятельная проверка подлинности ювелирных изделий из серебра
Серебро – благородный металл, свойства которого по достоинству оценены еще много веков назад. Чистое серебро и сплавы на его основе широко используются при изготовлении ювелирных изделий, посуды, столовых приборов, в приборостроении.
Проба
Стоимость серебра достаточно высока, и,кстати, в последнее время цены на этот металл на мировых биржах постоянно растут. Не удивительно, что и количество подделок и фальсификаций также увеличивается
При покупке серебряных вещей прежде всего нужно обращать внимание на пробу. Ее подделать достаточно сложно: изготовить клише под силу лишь специалистам экстра-класса
На поверхности изделия проба должно быть хорошо читаемой, с ровными, четкими очертаниями. Пробирное клеймо на серебряных изделиях российского производства имеет вид прямоугольника, внутри которого пропечатана трехзначная цифра, показывающая долю химически чистого серебра в изделии.
Количество примесей определяет качество металла. Наиболее распространены следующие пробы: 720, 750, 800, 875, 916, 925, 960. Проба 720 означает, что в ювелирном сплаве содержится 72% серебра, 750 – 75% и так далее. Из этой зависимости следует, что чем выше проба, тем более высокой будет стоимость изделия.
Сплавы 750 и 800 содержат много меди, поэтому они желтоватые на вид. Из них обычно изготавливают столовые приборы. Серебро этой пробы подвержено окислению, поэтому чистить ложки и вилки придется достаточно часто.
Качественное серебро, используемое для производства ювелирных украшений, имеет пробу 925 и выше.
Проверка подлинности
Если на изделии, выдаваемом за серебряное, нет пробы, можно обратиться за определением к ювелиру, например, отнести в ломбард и попросить оценить. Кроме того, существует много способов проверить подлинность вещи самостоятельно.
Экспресс-способы определения подлинности серебра в домашних условиях
Один из верных способов – магнит: серебро не должно притягиваться. Однако, одного этого теста не достаточно: очень много сплавов, имитирующих серебро, также не обладают магнитными свойствами.
Для определения пользуются серной мазью, которую можно купить в любой аптеке. Изделие надо намазать толстым слоем и дать полежать пару часов. Подлинное серебро или сплав с высоким содержанием этого драгоценного металла обязательно почернеет.
Тест с помощью йода. Под капелькой спиртового раствора йода серебро тоже чернеет, причем, чем выше его качество, тем сильнее
Но здесь надо действовать осторожно, эти манипуляции могут привести к порче вещи, поскольку удалить пятно будет очень трудно.
Часто за серебро выдают посеребренную латунь или медь. Можно сделать царапинку в неприметном месте: если на краях надпила появится красноватый или рыжий оттенок, это — подделка.
Серебро достаточно легко гнется, а после прекращения воздействия не восстанавливает форму (посеребренные медт и латунь слабо пружинят, т. к
обладают высокой упругостью).
Серебро обладает высокой теплопроводностью. Вещь, опущенная в горячую воду, моментально нагревается. Также она быстро принимает температуру человеческого тела.
При ношении поддельного украшения на коже остаются темные полосы. Это указывает на добавку значительно более дешевого цинка. Украшения из таких сплавов очень хрупкие, часто ломаются.
У серебра есть специфический запах, люди с чувствительным обонянием могут определить подлинность изделия.
Все эти способы проверки достоточно поверхностные, и могут быть использованы лишь для предварительной оценки. Гарантию, что изделие изготовлено из серебра, а не просто посеребренное, может дать только эксперт-ювелир. Чтобы удостовериться в подлинности на 100%, придется делать надпил или проводить расчеты с удельным весом.
Настоящее серебро со временем темнеет. Но на это нужны годы, кроме того, его блеск можно легко вернуть. Для этого пользуются специальным кремом или нашатырным спиртом. Блеск низкокачественных изделий пропадает навсегда.
Тест на серебро
Один из самых точных методов определения подлинности серебра в домашних условиях — тест на серебро, который можно купить в специализированных магазинах или через интернет. Следуя простой инструкции, с большой долей вероятности можно определить не только подлинность изделия, но и примерную пробу.
Существуют электронные приборы, способные отличить серебро, золото, белое золото, платину. Однако стоимость их настолько высока, что покупка с целью разового определения драгоценных металлов в домашних условиях экономически не оправдана.
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
-
оксид образует только литий
4Li + O2 = 2Li2O
-
натрий образует пероксид
2Na + O2 = Na2O2
-
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Бериллий (Be)
В отличие от предыдущих, этот металл, расположенный в таблице химэлементов под номером 4, отличает сероватый цвет, а также повышенная токсичность. Характеризуется хрупкостью при сравнительной твердости, превосходящей показатели алюминия и магния. Плотность — 1,8 г/см^3. Атомная масса — 9 углеродных единиц.
Открытый в конце XVIII века, в чистом виде впервые был получен только спустя 30 лет, в 1828 году. Название свое унаследовал от минерала берилла, который, в свою очередь, наименованием обязан индийскому городу Белуру, прославившемуся месторождением изумрудов — драгоценных камней, представляющих собой разновидность упомянутой породы.
Бериллий, фото: https://ru.m.wikipedia.org/
Бериллий часто встречается в составе темноцветных минералов, а также в магматических породах. Месторождения, содержащие этот металл, расположены на территории Южной Америки и Африки. На евразийском континенте также ведется добыча, преимущественно в Индии, Казахстане и России, в границах которой находятся два месторождения — в Свердловской области и в Бурятии.
Металл применяют в легировании сплавов в качестве добавки, делающей получаемые материалы более твердыми, прочными и устойчивыми к коррозии. Слабое поглощение бериллием рентгеновского излучения позволяет применять его при создании детекторов гамма-лучей. Применяется и в ядерной энергетике в качестве замедлителя нейтронов. Бериллиевые сплавы используют в аэрокосмической технике и для изготовления лазерных излучателей.
Также металл хорошо проводит звуковые волны, благодаря чему применяется в конструкции акустических устройств, однако из-за высокой сложности обработки для исключения негативных качеств, включая токсичность, изготовленные на его основе компоненты отличаются повышенной стоимостью. Представляет опасность для человека — накапливаясь в организме, приводит к тяжелому поражению органов дыхания, а также характеризуется выраженным канцерогенным воздействием.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Технология производства
Определить из чего делают белую жесть, позволяет сам процесс изготовления материала, проводимый в ряд последовательных этапов:
- выплавка стали заданного химического состава;
- прокатка металла, предварительно – горячая и последующая – холодная;
- отжиг в колпаковых печах или на другом оборудовании;
- правка;
- нанесение защитного покрытия;
- пассивация;
- промасливание.
Производство луженой стали – белой жести
Таким образом, исходным материалом под белую жесть выступает сталь. Как правило, это конструкционные марки металла: кипящая – 10кп и 8кп, а также полуспокойная – 10пс, 8пс. Полученные тонкие стальные листы с уже нанесенным защитным слоем разрезают по размерам, упаковывают, и отправляют потребителям.
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
3 Fe + 2 O2 → Fe3O4
2 Fe + 3 Cl2 → 2 FeCl3
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe2+ — 2e → Fe
Катод: 2H+ + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Защитные покрытия
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Периодическая таблица Менделеева
 Периодическая система была составлена Дмитрием Менделеевым во второй половине 19 века. Открытие не только позволило упростить работу химиков, она смогла объединить в себе как в единой системе все открытые химические вещества, а также предсказать будущие открытия.
Периодическая система была составлена Дмитрием Менделеевым во второй половине 19 века. Открытие не только позволило упростить работу химиков, она смогла объединить в себе как в единой системе все открытые химические вещества, а также предсказать будущие открытия.
Создание данной структурированной системы бесценно для науки и для человечества в целом. Именно это открытие дало толчок развитию всей химии на долгие годы.
В интервью одному журналисту ученый объяснил, что работал над ней 25 лет и то, что она ему снилась – вполне естественно, но это не значит, что во сне пришли все ответы.
Созданная Менделеевым система делится на две части:
- периоды – столбики по горизонтали в одну или две строки (ряды),
- группы – вертикальные строчки, в один ряд.
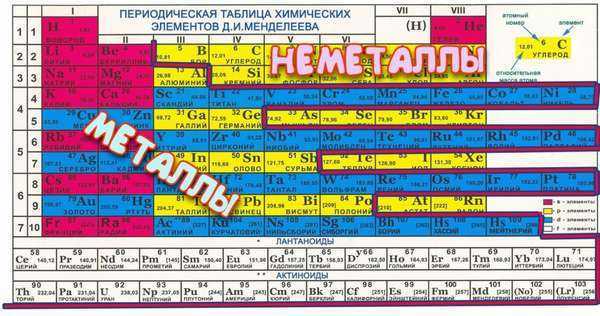
Всего в системе 7 периодов, каждый следующий элемент отличен от предыдущего большим количеством электронов в ядре, т.е. заряд ядра каждого правого показателя больше левого на единицу. Каждый период начинается с металла, а заканчивается инертным газом – именно это и есть периодичность таблицы, ведь свойства соединений меняются внутри одного периода и повторяются в следующем. При этом, следует помнить, что 1-3 периоды неполные или малые, в них всего 2, 8 и 8 представителей. В полном периоде (т.е. оставшихся четырех) по 18 химических представителей.
 В группе располагаются химические соединения с одинаковой высшей валентностью, т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
В группе располагаются химические соединения с одинаковой высшей валентностью, т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
Для облегчения поиска группы имеют свое название, а металлические свойства субстанций усиливаются с каждой нижней строчкой, т.е. чем ниже соединение, тем больше у него будет атомных орбит и тем слабее электронные связи. Также меняется и кристаллическая решетка – она становится ярко выраженной у элементов с большим количеством атомных орбит.
В химии используют три вида таблиц:
- Короткая – актиноиды и лантаноиды вынесены за границы основного поля, а 4 и все последующие периоды занимают по 2 строчки.
- Длинная – в ней актиноиды и лантаноиды вынесены за границу основного поля.
- Сверхдлинная – каждый период занимает ровно 1 строку.
Главной считается та таблица Менделеева, которая была принята и подтверждена официально, но для удобства чаще используют короткую версию. Металлы и неметаллы в таблице Менделеева располагаются согласно строгим правилам, которые облегчают работу с ней.






























